Mieloma múltiple:
Avances recientes en su tratamiento

Alexis M. Cruz Chacón, MD FACP
Hematólogo Oncólogo especialista en Trasplante de Médula Ósea de pacientes adultos
Director Médico, Programa de Trasplante de Médula Ósea, Hospital Auxilio Mutuo
Clínica de Malignidades Hematológicas, Centro Comprensivo de Cáncer de la UPR

Joel López Figueroa, MD
Hematólogo Oncólogo especialista en Mieloma Múltiple
Clínica de Mieloma Múltiple, Programa de Trasplante de Médula Ósea, Hospital Auxilio Mutuo
El mieloma múltiple es una malignidad hematológica cuyo tratamiento representa un gran reto debido a que ninguna de las terapias disponibles en la actualidad se considera curativa. Gracias al mejor entendimiento de esta enfermedad, se han podido crear nuevos tratamientos más efectivos que representan una promesa de mejores resultados en el futuro.
Conceptos básicos sobre mieloma múltiple
El mieloma múltiple (MM) representa el 10% de las malignidades hematológicas y predomina en adultos mayores (edad promedio: 69 años). Por otro lado, según las últimas estadísticas publicadas por el Registro del Centro Comprensivo de Cáncer de la Universidad de Puerto Rico, en el periodo 2014-2018 hubo una incidencia de 1,365 casos de mieloma múltiple, lo que representa un 21% de los diagnósticos de malignidades hematológicas en la isla.
El MM se caracteriza por la infiltración de células plasmáticas en la médula ósea, que producen una proteína anormal en suero y/u orina (pico monoclonal o M-spike) compuesta por anticuerpos que contienen cadenas pesadas (IgG, IgA, IgM) y/o cadenas ligeras (kappa, lamba). Para el diagnóstico de MM, debe haber una proteína monoclonal en suero sobre 3 g/dL o una infiltración de células plasmáticas en médula ósea mayor del 10%. La evaluación inicial cuando se sospecha MM requiere múltiples pruebas de laboratorio, incluyendo electroforesis de proteína con inmunofluorescencia en suero y orina, niveles de cadenas pesadas y ligeras en suero y colección de orina de 24 horas para proteína. Las células plasmáticas pueden producir exclusivamente cadenas ligeras de inmunoglobulina (kappa, lambda) que, debido a su pequeño tamaño, no pueden ser detectadas como una proteína monoclonal en suero por la electroforesis, pero sí midiendo sus niveles en suero o en una colección de orina (proteínas de Bence Jones). Se requiere de una biopsia de médula ósea y de estudios de imagen para detectar lesiones óseas o plasmocitomas. Las manifestaciones clínicas más comunes en el MM son lesiones osteolíticas sintomáticas (70%), anemia (30%), insuficiencia renal (20-25%) e hipercalcemia (15-20%). Para estos síntomas, se utiliza el acrónimo inglés CRAB (Calcium; Renal insufficiency; Anemia; Bone lesions). Ante cualquiera de estos hallazgos clínicos, el MM se considera sintomático y requiere tratamiento. Algunos pacientes con MM se mantienen sin ningún síntoma ni manifestación de enfermedad, lo que se conoce como MM asintomático o quiescente. Hay factores pronósticos importantes en los pacientes con MM como la edad, el estado de salud general (condición física, funcional y comorbilidades), anormalidades genéticas y respuesta al tratamiento inicial.
Tratamiento inicial
Por muchos años, el consenso fue que un paciente con MM solo debía tratarse al tener síntomas (CRAB). Sin embargo, los estudios han identificado a un grupo de pacientes con MM asintomático que tienen un mayor riesgo de progresión y que también se benefician de comenzar un tratamiento inmediato luego del diagnóstico. Las características de este grupo de pacientes son: infiltración de células plasmáticas en médula ósea ≥60%, proporción de cadenas ligeras de inmunoglobulina anormales ≥100 (kappa o lambda) y presencia de alguna lesión ósea focal en MRI.
Por muchos años, el tratamiento estándar de primera línea para el MM ha sido la terapia de inducción, seguida por la consolidación con trasplante de progenitores hematopoyéticos (TPH) del tipo autólogo (utilizando células madre extraídas del mismo paciente). Por esta razón el plan de tratamiento inicial depende de si el paciente se considera o no un candidato a trasplante, lo que no debe basarse en la edad, sino en otros factores importantes como la condición física, el estado funcional y las comorbilidades. Los estudios han demostrado que los mayores de 70 años tienen una mayor tasa de mortalidad por TPH autólogo. En los últimos años, la aprobación de nuevos agentes biológicos y de la inmunoterapia ha dado paso a mejores opciones de tratamiento para quienes no son candidatos a TPH autólogo. Uno de los tratamientos más novedosos y efectivos son los anticuerpos monoclonales contra el receptor CD38 en las células plasmáticas. Dos agentes de este tipo (daratumumab, isatuximab) han sido aprobados en varias combinaciones con otras drogas.
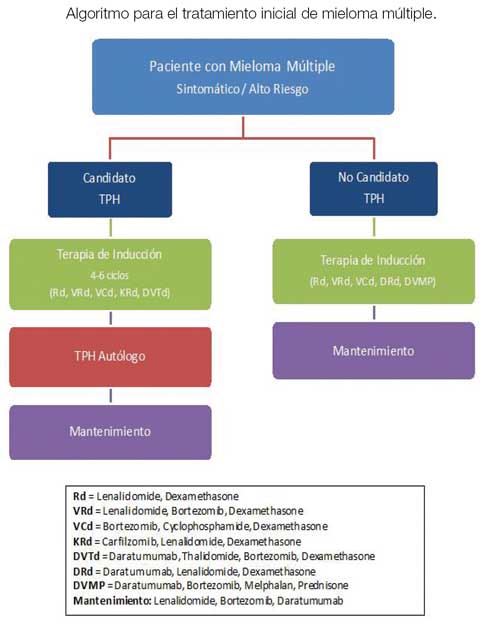
Evolución del tratamiento de MM
Antes, la terapia de inducción consistía en una combinación de quimioterapia y/o esteroides en dosis elevadas. Los nuevos conocimientos dieron paso a nuevas terapias biológicas y moleculares igual de efectivas que la quimioterapia tradicional que, al actuar de forma más directa, tienen menos toxicidad y efectos secundarios. Estos agentes se distinguen por su mecanismo de acción. Las primeras terapias dirigidas fueron los inhibidores del proteosoma y los agentes inmunomoduladores. Estos se utilizan en la gran mayoría de las combinaciones y han demostrado eficacia en diversos ensayos clínicos, tanto en primera línea como en recaídas. Gracias a su incorporación en los protocolos de inducción, se han logrado mejores tasas de remisión completa (RC) pre y postrasplante. Esto ha llevado a una revolución en el tratamiento de MM.
Los inhibidores de proteosoma bloquean la acción de los proteosomas, que son complejos celulares que descomponen proteínas. Muchas de estas proteínas son factores pro-apoptóticos, lo que promueve la activación del proceso de muerte celular programada en células neoplásicas que dependen de la supresión de las vías de apoptosis. En esta clase están bortezomib (subcutáneo), carfilzomib (intravenoso) e ixazomib (oral). Estos agentes son de suma importancia en el tratamiento de pacientes que se consideran de alto riesgo en base a la presencia de anormalidades citogenéticas específicas.
Los agentes inmunomoduladores (IMiDs) son análogos de la talidomida y tienen un mecanismo de acción múltiple que incluye la inducción de apoptosis directa frente a células tumorales malignas, la interferencia con las interacciones del tumor con el micromedioambiente celular en la médula ósea y el aumento de la respuesta inmunitaria antitumoral por linfocitos T citotóxicos y las células NK (naturales asesinas). Tienen mayor actividad inmunomoduladora y mejor perfil de seguridad que la talidomida. Los dos IMiDs disponibles son lenalidomida y pomalidomida.
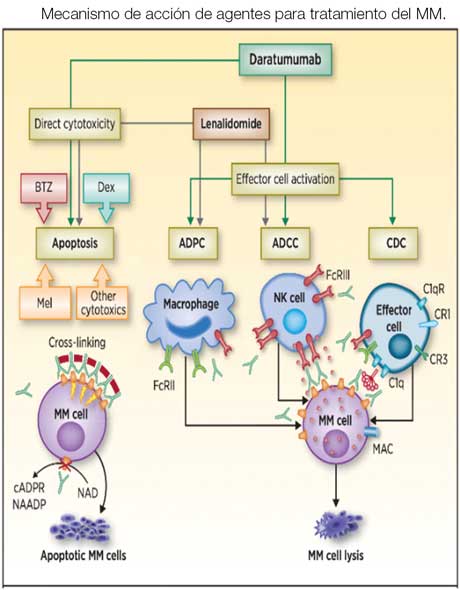
Los anticuerpos monoclonales (MoAb) se han integrado recientemente al tratamiento del MM. Estos se han convertido en una parte esencial de la terapia pues añaden un efecto terapéutico a la célula tumoral (CDC, ADCC o ADCP) y al sistema inmunológico, mejorando significativamente la efectividad del tratamiento sin aumentar su toxicidad. El primer MoAB aprobado para el MM fue elotuzumab, dirigido contra SLAMF-7 (signalling lymphocytic activating molecule family member 7). Esta molécula es expresada por las células NK, que son activadas por la unión del anticuerpo monoclonal y las células plasmáticas sobre las que elotuzumab ejerce un efecto antitumoral. Está aprobado en combinación con lenalidomida o pomalidomida junto a dexametasona para pacientes que han recibido de 1 a 3 líneas de tratamiento previas. Los otros MoAb aprobados son daratumumab e isatuximab. Ambos están dirigidos contra la glicoproteína CD38, presente en la superficie de las células plasmáticas. Su acción no es solo antitumoral por su citotoxicidad directa (CDC, ADCC, ADCP), sino también tienen efectos directos sobre las células efectoras del sistema inmunológico, como la activación de linfocitos T. Han sido aprobados como parte de varias combinaciones para el tratamiento inicial y las recaídas. Los MoAbs se han incorporado cada vez más a los algoritmos terapéuticos y representan una nueva tendencia en el tratamiento del MM.
Selinexor es otra droga aprobada para el tratamiento de MM. Cuenta con un mecanismo de acción distinto: es un inhibidor de la exportación nuclear. Inhibe la exportación de proteínas supresoras y reguladores del crecimiento de tumores al bloquear la molécula XPO1. Esto provoca un aumento en la supresión del tumor, que conduce a la muerte de las células cancerosas. Está aprobado en combinación con dexametasona o bortezomib en pacientes con MM en recaída o refractario que hayan recibido 4 o más terapias previas que incluyan al menos 2 inhibidores de proteosoma, 2 iMiDs y 1 MoAb anti-CD38. Para estos pacientes no hay otras opciones de tratamiento disponibles. Ha sido el primer fármaco aprobado con esta indicación.
Trasplante de médula ósea
El TPH autólogo es parte del tratamiento estándar para pacientes con MM que responden a la terapia de inducción inicial o como rescate luego de una recaída. A pesar de ser efectivo, el TPH autólogo no es considerado un tratamiento curativo para el MM. Su beneficio consiste en prolongar la sobrevida libre de enfermedad. Una estrategia implementada para prolongar este periodo es la utilización de los fármacos como terapias de mantenimiento postrasplante. Algunos pacientes que sufren una recaída a un año y medio o más luego de un primer TPH autólogo y que responden a un tratamiento de rescate pueden considerarse para un segundo TPH autólogo.
Los resultados obtenidos en MM gracias a las nuevas terapias biológicas y moleculares, en conjunto con el potencial de utilización de estos agentes como terapias de mantenimiento, levantaron en algún momento una controversia sobre si aún es necesario realizar un TPH autólogo como parte del tratamiento inicial de MM. Estudios clínicos realizados para contestar esto demostraron que la tasa de sobrevida libre de enfermedad aún sigue siendo mayor en los pacientes que se realizan un TPH autólogo. Se recomienda que todo paciente diagnosticado con MM sea referido en la etapa temprana de su tratamiento a un especialista en trasplante de médula ósea para evaluación.
La mayoría de los estudios reportados sobre el uso de TPH alogénico –utilizando células madre extraídas de un donante– en MM han demostrado una tasa de recaída similar a la lograda con TPH autólogo, pero con una mayor mortalidad. Los mejores resultados con TPH alogénico se han obtenido en pacientes jóvenes con enfermedad de alto riesgo que tienen mucha enfermedad residual o una recaída temprana –menos de un año– luego de recibir un TPH autólogo. Actualmente, el TPH alogénico en MM aún se considera experimental y no debe ofrecerse fuera de un estudio clínico o de un centro especializado.
Nuevas terapias dirigidas y CART
BCMA (B-cell Maturation Antigen) es un receptor de proteína expresado de manera más abundante y selectiva en las células de mieloma múltiple, que contribuye a un aumento en la señalización a favor del crecimiento, lo que hace que proliferen en exceso. La cantidad de proteínas BCMA presentes en la superficie de la célula plasmática maligna es mucho mayor que en las células plasmáticas sanas. Esto ha convertido a este receptor en un objetivo prometedor para nuevos tratamientos. Por eso existe un gran interés de desarrollar fármacos e inmunoterapias que ataquen el BCMA. Belantamab mafodotin es la primera de estas terapias para el tratamiento de los pacientes con mieloma múltiple en recaída cuya enfermedad ha sido refractaria a un tratamiento previo que incluya inhibidores de proteosoma, iMiDs y MoAb anti-CD38. El belantamab mafodotin es clasificado como un inmunoconjugado, que combina un anticuerpo monoclonal en contra del BCMA con un agente de quimioterapia. De esta forma, es un tratamiento que va dirigido a las células de mieloma múltiple.
El tratamiento conocido como CAR-T (Chimeric Antigen Receptor T-Cells) es una terapia celular en la que se extraen linfocitos o células T del paciente y se modifican en el laboratorio para que puedan atacar a las células cancerosas más efectivamente. Mediante la biotecnología, se añade a los linfocitos T un gen para expresar un receptor especial que se une a una proteína específica de las células cancerosas del paciente. En el laboratorio se producen grandes cantidades de estas células y, luego, se administran al paciente mediante infusión.
Actualmente, la terapia CAR-T dirigida al receptor BCMA ha demostrado resultados muy prometedores en los pacientes con MM más avanzado que han recibido múltiples líneas de tratamiento. Este tratamiento ha sido capaz de producir respuestas completas en pacientes que no tenían ninguna otra opción terapéutica. En marzo de 2021, la FDA aprobó el primer CAR-T, idecabtagene vicleucel para pacientes con MM que no respondieron o que volvieron después de por lo menos 4 tratamientos previos diferentes.
Conclusión
Los descubrimientos y avances en MM siguen dando lugar a nuevas terapias más efectivas y menos tóxicas que los tratamientos convencionales. Sin embargo, el MM es aún considerado una condición incurable. Los resultados y seguimiento a largo plazo de estudios con las nuevas modalidades de terapias son muy prometedores. La integración de estas nuevas terapias con los tratamientos tradicionales –incluyendo el TPH autólogo y el desarrollo de las nuevas terapias celulares– podrían representar la esperanza de mejores resultados en el futuro y una posible cura del MM.
Referencias
- Hideshima T, Richardson P, et al. The proteasome inhibitor PS-341 inhibits growth, induces apoptosis, and overcomes drug resistance in human multiple myeloma cells. Cancer Res 2001; 61 (7): 3071-6.
- Davies FE, Raje N, Hideshima T, Lentzsch S, Young G, Tai YT, et al. Thalidomide and immunomodulatory derivatives augment natural killer cell cytotoxicity in multiple myeloma. Blood 2001; 98 (1): 210-6.
- Weiner LM, Murray JC, Shuptrine CW. Antibody based immunotherapy of cancer. Cell. 2012;148(6):1081-4.
- Krejcik J, Casneuf T, Nijhof IS, Verbist B, et al. Daratumumab depletes CD38+ immune regulatory cells, promotes T-cell expansion, and skews T-cell repertoire in multiple myeloma. Blood. 2016;128(3):384-94.
- Hamed RA, et al. Current status of autologous stem cell transplantation for multiple mieloma. Blood Cancer J (2019) 9:44.
- Susanibar SP, et a. Chimeric antigen receptor T cell immunotherapy for multiple myeloma: Am J Hematol. 2019 May;94(S1): S28-S33.
- Laubach J P, Richardson PG. CD38-Targeted immunochemotherapy in refractory multiple myeloma. Clin Canc Reseach. 2015; 21: 2660–2.
- Cancer Facts & Figures 2022. American Cancer Society. 2022.








