Inmunoterapia en cáncer:
Beneficios y riesgos del tratamiento

Justiniano Castro, MD
Hematólogo-Oncólogo
Sección de Hematología-Oncología
Hospital Universitario, Departamento de Medicina
Recinto de Ciencias Médicas de la Universidad de Puerto Rico
Introducción
La inmunooncología estudia cómo nuestro sistema inmune interacciona frente a las células malignas. Se conoce como inmunovigilancia al proceso de controlar y destruir –de ser necesario– las células cancerosas que se forman en nuestro organismo. Recientemente, se ha encontrado que muchas veces el sistema inmune actúa como inmunomodificador a través de receptores y/o citoquinas para hacer más vulnerables a estas células malignas que han perdido los controles normales.
Algunos de los mecanismos de control inmune más importantes que se conocen en la actualidad son los siguientes:
- CTLA-4: antígeno 4 del linfocito T citotóxico. Este receptor está presente en las células T y controla su activación. Las células malignas pueden manipular este receptor para escapar de la vigilancia;
- PD-L1: el ligando 1 de muerte celular programada (PD-L1) es una proteína transmembrana de tipo 1 que juega un rol inmunoregulador mediante la supresión del sistema inmune en procesos fisiológicos como el embarazo, la presentación de antígenos a linfocitos T, el trasplante de órganos y también en procesos patológicos, como en las enfermedades inmunológicas, en el cáncer y en las enfermedades infecciosas;
- Tim3: receptor 3 inhibidor de dominio de mucina de los linfocitos T. Controla la función del linfocito T4 ayudante; y
- Lag3: gen activador de linfocitos que puede inducir anergia linfocitaria. Las células malignas lo pueden inhibir.

Estas alteraciones dificultan establecer una respuesta adecuada contra estas células, que escapan así de los controles normales, produciendo la enfermedad.
Conociendo estos mecanismos de escape, se han desarrollado múltiples terapias para restablecer los controles normales y destruir las células malignas. Estos incluyen las siguientes opciones:
Citoquinas
- Interleucina 2: citoquina que activa los linfocitos T. Se usa para tratar melanoma y tumores renales;
- Lenalidomida/pomalidomida: inmunomodulador, para el tratamiento de mieloma múltiple y de linfomas;
- Interferón alfa: inactiva proteínas STAT 1, 2, en tratamiento de melanoma; y
- BCG: inductor de citoquinas y activación de linfocitos, de aplicación en cáncer de vejiga.
Inhibidores de punto
Son anticuerpos monoclonales contra el ligando 1 de muerte celular programada (PD-L1). El bloqueo de PD-L1 revierte el agotamiento de las células T revitalizando la actividad antitumoral. Estos agentes son activos en múltiples tumores. Pueden trabajar como agentes sencillos o en combinación. La lista de estos agentes incluye: nivolumab (Opdivo), pembrolizumab (Keytruda), cemiplimab (Libtayo), durvalumab (Infinzi), avelumab (Bavencio) y atezolizumab (Tecentriq). Envafolimab es un inibidor del PD-L1 subcutáneo que está bajo estudio, muy activo contra varios tumores.
CTLA-4
Receptor que puede ser inhibido; ipilimumab es un anticuerpo monoclonal activo contra el melanoma, los tumores de pulmón y los tumores renales.
Receptor de antígeno quimérico (CAR-T)
Infusión de linfocitos manipulados que tiene indicación en linfomas y leucemias agudas (Tisagenlecleucel –Kymriah–).
Terapia dirigida contra CD3
Activador bioespecífico de células T, blinatumomab (Blincyto). Activo en leucemia linfoblástica aguda.
Virus oncolíticos
Entre estos, destaca la terapia contra el melanoma cutáneo por manipulación de los virus de herpes (Talimogene laherparepvec o T-VEC).
Vacunas
Se han desarrollado vacunas utilizando antígenos tumorales a través de ingeniería genética. Así, se dispone de sipuleucel-T que tiene indicación para tratar cáncer de próstata avanzado.
Se viene estudiando también el uso anticuerpos contra los receptores de las células asesinas (Natural Killer cells), la infusión de macrófagos infiltrantes de tumor y, además, la expresión de la enzima deoxigenasa 2,3 de indo-lámina puede manipularse para permitir que los inhibidores de PD-L1 recuperen su activad (mecanismo de resistencia).
Criterios de respuesta de la enfermedad
Se han modificado los criterios de respuesta de la enfermedad oncológica al usar inmunoterapia. Los cambios más importantes incluyen:
- El paciente puede tener un periodo de deterioro de la enfermedad al inicio del tratamiento. Esto se conoce como seudoprogresión;
- La respuesta de la enfermedad puede tomar más tiempo −a veces meses− en observarse; y
- La enfermedad puede no presentar respuesta objetiva por estudios de imágenes, pero el paciente puede presentar mejoría clínica.
La mayor diferencia que se describe para evaluar la respuesta al tratamiento es el término progresión no confirmada: puede aparecer una lesión nueva, y se debe esperar hasta la próxima reevaluación para determinar si aparecen más lesiones y confirmar la progresión de la enfermedad, dentro de las próximas 12 semanas.
Hiperprogresión de la malignidad
La hiperprogresión de la malignidad en pacientes de cáncer tratados con inmunoterapia se ha descrito en un 4% a un 29% de los casos, en su mayoría tratados por tumores de pulmón. Esta se define como un crecimiento rápido de la enfermedad en los pacientes que se encuentran en tratamiento.
Es importante tener un alto grado de sospecha acerca de cuándo debe detenerse el tratamiento. El pronóstico de estos pacientes tiende a ser pobre. Hasta ahora no se ha podido identificar alguna característica en especial que pueda predecir qué pacientes están en riesgo.
Efectos secundarios de la inmunoterapia
Los efectos secundarios asociados a la inmunoterapia y a los inhibidores de punto son variados.
En general, si el efecto secundario es leve, se puede manejar con un curso corto de corticoesteroides y parar el tratamiento por un tiempo corto.
En caso de eventos adversos severos, se deben usar altas dosis de corticoesteroides, detener el medicamento y considerar administrar infliximab (Remicade).
Los efectos secundarios más comunes se presentan en la siguiente tabla:
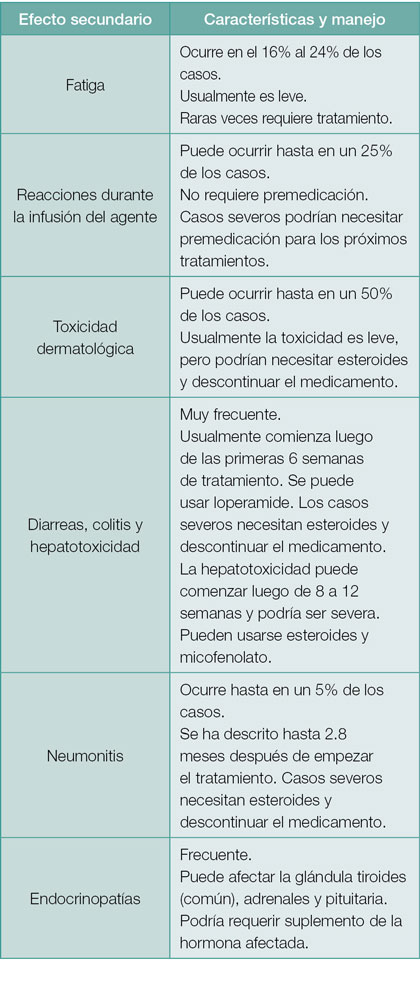
Otros efectos secundarios menos frecuentes son los siguientes: daño renal, pancreatitis, toxicidad cardiovascular, toxicidad neurológica (Guillan-Barre, miastenia gravis), toxicidad a la visión, problemas hematológicos y daño reumatológico o musculoesquelético.
Resumen
La inmunooncología es un área médica cuyos avances extraordinarios se han traducido en gran beneficio a los pacientes. Siendo la inmunoterapia un método de tratamiento activo para una extensa gama de tumores, debemos familiarizarnos con su manejo y espectro de eventos adversos.
También, debemos estar atentos a la información disponible y a los adelantos que contribuyan al beneficio de nuestros pacientes que son nuestra razón de ser.
Referencias
- Seminar Cancer Biol; 2015;35: Suppl S185.
- Int J Mol Sci; 2019; 20(11): 2674.
- Ann Oncology; 2016; 27:559.
- Jama Oncol; 2018; 4:17.
- Science; 2015; 348:62.
- Cancer Immunol; May-2014:2(5): 393-8.
- NEJM; 2016; 375:1845.
- NEJM; 2017; 377:1824.








